Ⅰ. Lisää reaktiojärjestelmän herkkyyttä:
1. Erottele korkealaatuinen RNA:
Onnistunut cDNA-synteesi tulee korkealaatuisesta RNA:sta.Korkealaatuisen RNA:n tulisi varmistaa vähintään kokonaispituus, eikä se sisällä estäjiä, jotka eivät sisällä tallentavia entsyymejä, kuten EDTA tai SDS.RNA:n laatu määrittää sekvenssitiedon enimmäisarvon, jonka voit kopioida cDNA:ksi.Yleinen RNA-puhdistusmenetelmä on isoosyanaatti/asidofenoli-vaihemenetelmä.RNaasin saastumisen estämiseksi RNaasi-rikkaasta näytteestä (kuten haimasta) erotettu RNA vaatii formaldehydin varastointia korkealaatuisen RNA:n säästämiseksi, mikä on vielä enemmän pitkäaikaista varastointia varten.Rotan maksasta uutettu RNA hajosi periaatteessa yhden viikon vedessä säilytyksen jälkeen, kun taas rotan pernasta uutettu RNA pysyi stabiilina kolmen vuoden vedessä säilytyksen jälkeen.Lisäksi yli 4 kb:n transkriptit ovat herkempiä RNaasi-hajoamisen jäljitykselle kuin pienet transkriptit.Varastoitavan RNA-näytteen stabiilisuuden lisäämiseksi RNA voidaan liuottaa ionin metalmamiiniin ja säilyttää -70 °C:ssa.RNA:n säästämiseen käytetty tylidi ei saa sisältää sekalaista esinettä, joka hajottaa RNA:ta.Haimasta peräisin olevaa RNA:ta voidaan säilyttää metamamiinissa vähintään vuoden ajan.Kun olet valmis käyttämään RNA:ta, voit käyttää seuraavia menetelmiä RNA:n saostamiseen: lisää NaCl 0,2 m:iin ja 4-kertaiseen tilavuuteen etanolia, aseta huoneenlämpöön 3-5 minuutiksi ja 10 000 × g keskipakoisiksi 5 minuutiksi.
2. Käytä käänteistranskriptaasia ilman RNaseH-aktiivisuutta (RNaseH-)
RNaasi-inhibiittoreita lisätään usein käänteistranskriptioreaktioihin lisäämään cDNA-synteesin pituutta ja saantoa.RNaasi-inhibiittori lisätään ensimmäisessä ketjusynteesireaktiossa puskurien ja pelkistysaineiden, kuten DTT:n, läsnä ollessa, koska pre-cDNA-synteesiprosessi denaturoi inhibiittorin ja vapauttaa siten sitoutuneita RNAaseja, jotka hajottavat RNA:ta.Proteiinin RNaasi-inhibiittori estää vain RNA:n hajoamisen RNaasi A:n, B:n, C:n vaikutuksesta, eivätkä estä RNaasien muodostumista iholle, joten on varottava, ettei RNaaseja pääse kulkeutumaan sormista näiden estäjien käytöstä huolimatta.
Käänteistranskriptaasi katalysoi RNA:n muuntamista cDNA:ksi.Sekä M-MLV:llä että AMV:llä on endogeeninen RNaseH-aktiivisuus oman polymeraasiaktiivisuutensa lisäksi.RNaseH-aktiivisuus kilpailee polymeraasiaktiivisuuden kanssa heterotsygoottisista juosteista, jotka muodostuvat RNA-templaattien ja DNA-alukkeiden tai cDNA-pidennysjuosteiden väliin, ja hajottaa RNA:RNA-säikeitä DNA-komplekseissa.RNaseH-aktiivisuuden hajottamia RNA-templaatteja ei voida enää käyttää tehokkaina substraatteina cDNA-synteesiin, mikä vähentää cDNA-synteesin saantoa ja pituutta.Siten käänteistranskriptaasin RNaseH-aktiivisuuden eliminoiminen tai huomattava vähentäminen olisi suurta hyötyä.
SuperScriptⅡ-käänteistranskriptaasi, RNaseH- ja thermoScript-käänteiskopioijaentsyymin MMLV-käänteiskopioija, RNaseH:n AMV tuottivat enemmän täyspitkää cDNA:ta kuin MMLV ja AMV.RT-PCR-herkkyyteen vaikuttaa syntetisoidun cDNA:n määrä.ThermoScript on paljon herkempi kuin AMV.RT-PCR-tuotteiden kokoa rajoittaa käänteistranskriptaasin kyky syntetisoida cDNA:ta, erityisesti kloonattaessa suurempia Cdnas:ita.Verrattuna MMLV:hen SuperScripⅡ lisäsi merkittävästi pitkien RT-PCR-tuotteiden saantoa.RNaseH-n käänteistranskriptaasi lisää myös lämpöstabiilisuutta, joten reaktio voidaan suorittaa normaalia korkeammissa lämpötiloissa 37-42 ℃.Ehdotetuissa synteesiolosuhteissa käytettiin oligo(dT)-alukkeita ja 10 µCi [alfa-p]dCTP:tä.Ensimmäisen ketjun kokonaistuotanto laskettiin TCA-saostusmenetelmällä.Täyspitkä cDNA analysoitiin käyttämällä kokolajiteltujen kaistaleiden poistoa ja laskemista alkalisessa agaroosigeelissä.
3. Nosta käänteisen transkription lämmön säilytyslämpötilaa:
Korkeampi pitolämpötila auttaa avaamaan RNA:n sekundaarirakenteen ja lisäämään reaktion saantoa.Useimmissa RNA-templaateissa RNA:n ja alukkeen pitäminen 65 °C:ssa ilman puskuria tai suolaa ja niiden nopea jäähdyttäminen jäällä eliminoi useimmat sekundaariset rakenteet ja mahdollistaa alukkeiden sitoutumisen.Joillakin mallineilla on kuitenkin edelleen toissijainen rakenne, jopa lämpödenaturoinnin jälkeen.Näiden vaikeiden templaattien monistaminen voidaan suorittaa käyttämällä ThermoScript-käänteistranskriptaasia ja asettamalla käänteistranskriptaasireaktio korkeampiin lämpötiloihin monistumisen parantamiseksi.Korkeammat säilytyslämpötilat voivat myös lisätä spesifisyyttä, varsinkin kun cDNA-synteesi suoritetaan käyttämällä geenispesifisiä alukkeita (GSPS) (katso luku 3).Jos käytät GSP:tä, varmista, että alukkeen Tm-arvo on sama kuin odotettu pitolämpötila.Älä käytä oligo(dT)- ja satunnaisia alukkeita yli 60 ℃.Satunnaisia alukkeita on pidettävä 25 ℃:ssa 10 minuuttia ennen kuin ne nostetaan 60 ℃:seen.Sen lisäksi, että käytetään korkeampia käänteistranskriptiolämpötiloja, spesifisyyttä voidaan parantaa siirtämällä RNA/aluke-seos suoraan 65 ℃:n denaturointilämpötilasta käänteistranskription säilytyslämpötilaan ja lisäämällä esilämmitetty 2x-reaktioseos (cDNA:n lämpöaloitussynteesi).Tämä lähestymistapa auttaa estämään molekyylien välisen emäsparin muodostumisen, joka tapahtuu alemmissa lämpötiloissa.PCR-instrumentin käyttö yksinkertaistaa monia RT-PCR:ssä tarvittavia lämpötilakytkimiä.
Lämpöstabiloitu Tth-polymeraasi toimii DNA-polymeraasina Mg2+:n läsnä ollessa ja RNA-polymeraasi Mn2+:n läsnä ollessa.Se voi pitää lämmön jopa 65 ℃.Mn2+:n läsnäolo PCR:n aikana kuitenkin heikentää tarkkuutta, mikä tekee Tth-polymeraasista vähemmän sopivan erittäin tarkkaan monistukseen, kuten cDNA-kloonaukseen.Lisäksi Tth on vähemmän tehokas käänteistranskriptiossa, mikä vähentää herkkyyttä, ja koska yksi entsyymi voi suorittaa käänteistranskription ja PCR:n, kontrollireaktioita ilman käänteistranskriptiota ei voida käyttää cDNA:n monistuneiden tuotteiden erottamiseen kontaminoituneen genomisen DNA:n tuotteista.
4. Käänteistranskriptiota edistävä lisäaine:
Lisäaineiden, mukaan lukien glyseriini ja DMSO, lisääminen ensimmäiseen ketjusynteesireaktioon voi heikentää nukleiinihapon kaksoisjuosteen stabiilisuutta ja purkaa RNA:n sekundaarirakennetta.Jopa 20 % glyseriiniä tai 10 % DMSO:ta voidaan lisätä vaikuttamatta SuperScriptⅡ- tai MMLV-aktiivisuuteen.AMV voi myös sietää jopa 20 % glyserolia vähentämättä aktiivisuutta.RT-PCR:n herkkyyden maksimoimiseksi SuperScriptⅡ-käänteistranskriptioreaktiossa voidaan lisätä 10 % glyserolia ja eristää 45 ℃:ssa.Jos PCR:ään lisätään 1/10 retrotranskriptioreaktiotuotteesta, glyserolin pitoisuus monistusreaktiossa on 0,4 %, mikä ei riitä estämään PCR:ää.
5. RNaseH-käsittely:
Herkkyyttä voidaan parantaa käsittelemällä cDNA-synteesireaktioita RNaseH:lla ennen PCR:ää.Joidenkin templaattien kohdalla ajatellaan, että RNA cDNA-synteesireaktiossa estää monistettujen tuotteiden sitoutumisen, jolloin RNaseH-käsittely voi lisätä herkkyyttä.Yleensä RNaseH-käsittelyä tarvitaan suhteellisen pitkän täyspitkän cDNA-kohdetemplaatin, kuten mukula-skeroosinⅡ, jossa on alhainen kopio, monistamiseksi.Tässä vaikeassa mallissa RNaseH tehosti SuperScriptⅡ:n tai AMV:n syntetisoiman cDNA:n tuottamaa signaalia.Useimmissa RT-PCR-reaktioissa RNaseH-käsittely on valinnainen, koska 95 ℃:n eristetty PCR-denaturaatiovaihe tyypillisesti hydrolysoi RNA:n RNA:DNA-kompleksista.
6. Parannetut menetelmät pienten RNA-määrien havaitsemiseen:
RT-PCR on erityisen haastava, kun saatavilla on vain pieniä määriä RNA:ta.Glykogeenin lisääminen kantaja-aineeksi RNA:n erotuksen aikana auttaa lisäämään pienten näytteiden saantoa.RNaasi-vapaata glykogeenia voidaan lisätä samaan aikaan Trizolin kanssa.Glykogeeni on vesiliukoista ja voi jäädä vesifaasiin RNA:n kanssa auttamaan myöhempää saostumista.RNaasi-vapaan glykogeenin suositeltu pitoisuus on 250 μg/ml näytteille, jotka sisältävät alle 50 mg kudosta tai 106 viljeltyä solua.
Asetyloidun BSA:n lisääminen käänteistranskriptioreaktioihin SuperScriptⅡ:n avulla voi lisätä herkkyyttä, ja pienille RNA-määrille SuperScriptⅡ:n määrän vähentäminen ja 40 yksikön RnaseOut-nukleaasi-inhibiittorin lisääminen voi parantaa havaitsemistasoa.Jos glykogeenia käytetään RNA:n erottamiseen, BSA- tai RNaasi-inhibiittoreiden lisäämistä SuperScriptⅡ-käänteiskopiointireaktioihin suositellaan edelleen.
Ⅱ. Lisää RT-PCR:n spesifisyyttä
1. cNDA-synteesi:
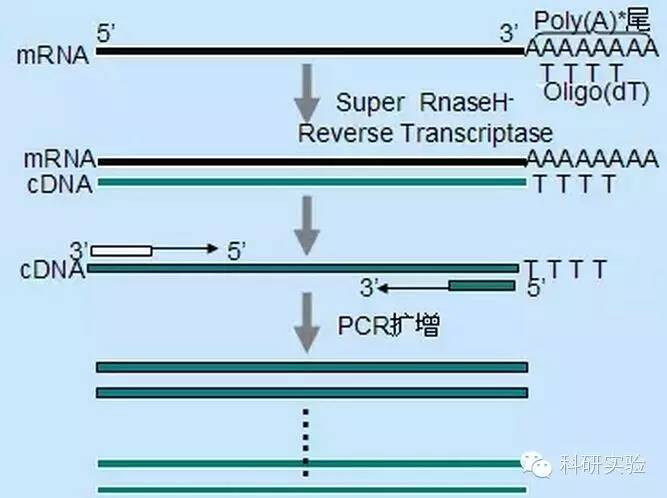
Ensimmäisen juosteen cDNA-synteesin aloittamiseen voidaan käyttää kolmea eri menetelmää, ja kunkin menetelmän suhteellinen spesifisyys vaikuttaa syntetisoidun cDNA:n määrään ja tyyppiin.
Random primer -menetelmä on vähiten spesifinen kolmesta menetelmästä.Alukkeet pariutetaan useissa kohdissa läpi transkriptin lyhyen, osittain pituisen cDNA:n tuottamiseksi.Tätä menetelmää käytetään usein 5'-terminaalisten sekvenssien ja cDNA:n saamiseksi RNA-templaateista, joissa on sekundaarisia rakennealueita tai lopetuskohtia, jotka käänteiskopioija ei voi replikoitua.Pisimmän cDNA:n saamiseksi kussakin RNA-näytteessä olevien alukkeiden suhde RNA:han on määritettävä empiirisesti.Satunnaisten alukkeiden alkupitoisuus vaihtelee välillä 50 - 250 ng 20 μl:n reaktiojärjestelmää kohti.Koska kokonais-RNA:sta satunnaisia alukkeita käyttäen syntetisoitu cDNA on pääasiassa ribosomaalista RNA:ta, poly(A)+RNA valitaan yleensä templaatiksi.
Oligo(dT)-aloitus on spesifisempi kuin satunnaiset alukkeet.Se hybridisoituu useimmissa eukaryoottisoluissa mRNA:n 3'-päässä olevan poly(A)-häntän kanssa.Koska poly(A)+RNA on noin 1 % - 2 % kokonais-RNA:sta, cDNA:n määrä ja kompleksisuus on paljon pienempi kuin jos käytettäisiin satunnaisia alukkeita.Korkean spesifisyytensä vuoksi oligo(dT) ei yleensä vaadi optimointia RNA:n ja alukkeen välistä suhdetta ja poly(A)+-valintaa varten.On suositeltavaa käyttää 0,5 μg oligo(dT) per 20 μl reaktiojärjestelmää.oligo(dT)12-18 sopii useimpiin RT-PCR:iin.ThermoScript RT-PCR System tarjoaa oligo(dT)20:n hyvän lämpöstabiiliuden ansiosta ja sopii korkeampiin säilytyslämpötiloihin.
Geenispesifiset alukkeet (GSP) ovat parhaita spesifisiä alukkeita käänteistranskriptiovaiheeseen.GSP on antisense-oligonukleosidi, joka voi spesifisesti hybridisoitua RNA:n kohdesekvenssien kanssa sen sijaan, että se parittaisi kaikki RNA:t, kuten satunnaiset alukkeet tai oligo(dT).PCR-alukkeiden suunnittelussa käytetyt säännöt koskevat myös käänteistranskriptioreaktion GSP:n suunnittelua.GSP voi olla sama sekvenssi kuin amplifikaatioaluke, joka on pariutunut mRNA3':n päähän, tai GSP voidaan suunnitella pariutumaan myötävirtaan käänteisamplifikaatioalukkeen kanssa.Joillekin monistetuille kohteille on välttämätöntä suunnitella useampi kuin yksi antisense-aluke onnistuneelle RT-PCR:lle, koska kohde-RNA:n sekundäärinen rakenne voi estää alukkeen sitoutumisen.Ensimmäisessä 20 μl:n ketjusynteesireaktiojärjestelmässä suositellaan käytettäväksi 1 pmol antisense GSP:tä.
2. Nosta käänteisen transkription lämmön säilytyslämpötilaa:
Jotta GSP-spesifisyydestä saataisiin täysi hyöty, tulisi käyttää käänteiskopioijaentsyymiä, jolla on korkea lämpöstabiilisuus.Lämmönkestävä käänteistranskriptaasi voidaan eristää korkeammissa lämpötiloissa reaktion jäykkyyden lisäämiseksi.Esimerkiksi, jos GSP lämpökäsitellään 55 °C:ssa, GSP:n spesifisyyttä ei hyödynnetä täysin, jos käänteistranskriptio suoritetaan 37 °C:ssa alhaisella tarkkuudella käyttäen AMV:tä tai M-MLV:tä.SuperScripⅡ ja ThermoScript voivat kuitenkin reagoida 50 ℃ tai korkeammassa lämpötilassa, mikä eliminoi epäspesifiset tuotteet, jotka tuotetaan alhaisemmissa lämpötiloissa.Maksimaalisen spesifisyyden saavuttamiseksi RNA/aluke-seos voidaan siirtää suoraan 65 ℃:n denaturaatiolämpötilasta käänteistranskription säilytyslämpötilaan lisäämällä esilämmitetty 2 x reaktioseos (cDNA-synteesin terminen aloitus).Tämä auttaa estämään emäsparien muodostumisen molekyylien välillä matalissa lämpötiloissa.PCR-instrumentin käyttö yksinkertaistaa monia RT-PCR:n edellyttämiä lämpötilan muutoksia.
3. Vähennä genomisen DNA:n kontaminaatiota:
Yksi mahdollinen vaikeus RT-PCR:ssä on se, että RNA saastuttaa genomisen DNA:n.Parempien RNA-erotusmenetelmien, kuten Trizol Reagentin, käyttö vähentää genomisen DNA:n kontaminaatiota RNA-valmisteissa.Genomisesta DNA:sta tuotettujen tuotteiden välttämiseksi RNA:ta voidaan käsitellä monistusluokan DnasⅠ:llä kontaminoituneen DNA:n poistamiseksi ennen käänteistranskriptiota.Näytteitä pidettiin 65 °C:ssa 2,0 mM EDTA:ssa 10 minuuttia DNaasiⅠ-digestion lopettamiseksi.EDTA kelaatoi magnesiumioneja estääkseen magnesiumionista riippuvan RNA:n hydrolyysin, joka tapahtuu korkeissa lämpötiloissa.
Monistetun cDNA:n erottamiseksi genomin DNA:n monistustuotteesta voidaan suunnitella alukkeita, jotka pariutuvat erikseen erotetun eksonin kanssa.cDNA:sta peräisin olevat PCR-tuotteet ovat lyhyempiä kuin saastuneesta genomisesta DNA:sta peräisin olevat PCR-tuotteet.Jokaiselle RNA-templaatille suoritetaan myös kontrolloitu koe ilman käänteistranskriptiota sen määrittämiseksi, onko tietty fragmentti genomisesta DNA:sta vai cDNA:sta.PCR-tuotteet, jotka on saatu ilman käänteistranskriptiota, ovat peräisin genomista.
Aiheeseen liittyvä tuote
-Yksivaiheinen pakkaus mahdollistaa käänteisen transkription ja PCR:n suorittamisen samassa putkessa.Sen tarvitsee vain lisätä templaatti-RNA, spesifiset PCR-alukkeet ja RNaasi-free ddH2O.
- RNA:n kvantitatiivinen reaaliaikainen analyysi voidaan suorittaa nopeasti ja tarkasti.
- Sarjassa käytetään ainutlaatuista Foregene-käänteistranskriptioreagenssia ja Foregene HotStar Taq DNA Polymerase yhdistettynä ainutlaatuiseen reaktiojärjestelmään, joka parantaa tehokkaasti amplifikaatiotehokkuutta ja reaktion spesifisyyttä.
-Optimoitu reaktiojärjestelmä tekee reaktiosta korkeamman tunnistusherkkyyden, vahvemman lämpöstabiilisuuden ja paremman sietokyvyn.
- Tehokas kyky poistaa gDNA, joka voi poistaa gDNA:n mallineesta 2 minuutissa.
- Tehokas käänteistranskriptiojärjestelmä, kestää vain 15 minuuttia ensimmäisen juosteen cDNA:n synteesin loppuun saattamiseksi.
- Monimutkaiset mallit: malleja, joissa on korkea GC-sisältö ja monimutkainen toissijainen rakenne, voidaan myös kääntää tehokkaasti.
- Korkean herkkyyden käänteiskopiointijärjestelmä, pg-tason mallit voivat myös saada korkealaatuista cDNA:ta.
-Käänteistranskriptiojärjestelmällä on korkea lämpöstabiilius, optimaalinen reaktiolämpötila on 42 ℃, ja sillä on edelleen hyvä käänteistranskriptiokyky 50 ℃:ssa.
Postitusaika: 07.03.2023