Uutena laboratoriona ei ole hyvä työ seuloa positiivisia kasveja kasveista, joiden muuntoprosentti on alhainen.Ensin DNA on uutettava suuresta määrästä näytteitä yksitellen, ja sitten vieraat geenit havaitaan PCR:llä.Tulokset ovat kuitenkin usein tyhjiä ja vyöhykkeitä, joissa on satunnaisesti muutamia kohteita, mutta on mahdotonta määrittää, onko havaittu jäänyt vai ei..Onko niin avutonta kohdata tällainen kokeellinen prosessi ja tulokset?Älä huoli, veli opettaa sinulle kuinka seuloa siirtogeeniset positiiviset kasvit helposti ja tarkasti.
Vaihe 1
Suunnittele tunnistusalukkeet
Määritä havaittava endogeeninen geeni ja eksogeeninen geeni testattavan näytteen perusteella ja valitse geenistä edustava 100-500 bp:n sekvenssi alukesuunnittelua varten.Hyvät alukkeet voivat varmistaa havaintotulosten tarkkuuden ja lyhentää havaitsemisaikaa (katso liitteestä yleisesti käytetyt tunnistusalukkeet).
Huomautus: Äskettäin suunniteltujen alukkeiden on optimoitava reaktio-olosuhteet ja varmistettava ilmaisun tarkkuus, tarkkuus ja havaitsemisraja ennen laajamittaista havaitsemista.
Vaihe 2
Suunnittele kokeellinen protokolla
Positiivinen kontrolli: Käytä kohdefragmentin sisältävää puhdistettua DNA:ta templaattina määrittääksesi, ovatko PCR-reaktiojärjestelmä ja olosuhteet normaaleja.
Negatiivinen/nollakontrolli: Käytä DNA-templaattia tai ddH2O:ta, joka ei sisällä kohdefragmenttia, templaattina havaitaksesi, onko PCR-järjestelmässä kontaminaatiolähde.
Sisäinen vertailukontrolli: käytä testattavan näytteen endogeenisen geenin aluke/koetinyhdistelmää arvioidaksesi, voidaanko templaatti havaita PCR:llä.
Ilmoitus:
Positiiviset, negatiiviset/nollakontrollit ja sisäiset kontrollit on asetettava jokaiselle kokeelle koetulosten validiteetin arvioimiseksi.
Kokeilun valmistelu
Tarkista ennen käyttöä, onko liuos sekoittunut tasaisesti.Jos sakkaa löytyy, se on liuotettava ja sekoitettava ohjeiden mukaisesti ennen käyttöä.2×PCR-seos on pipetoitava ja sekoitettava toistuvasti mikropipetillä ennen käyttöä ionien epätasaisen jakautumisen välttämiseksi.
Ilmoitus:
Ota käsikirja esiin ja lue se huolellisesti ja tee valmistelut ennen koetta tiukasti käsikirjan vaatimusten mukaisesti.
Vaihe 4
Valmistele PCR-reaktiojärjestelmä
Sekoita alukkeet, H2O ja 2×PCR-seos koekäytännön mukaisesti tasaisesti, sentrifugoi ja jaa ne jokaiseen reaktioputkeen.
Ilmoitus:
Laajamittaisessa tai pitkäaikaisessa testauksessa on suositeltavaa käyttää UNG-entsyymiä sisältävää PCR-reaktiojärjestelmää, jolla voidaan tehokkaasti välttää PCR-tuotteiden aiheuttama aerosolikontaminaatio.
Vaihe 5
Lisää reaktiomalli
Direct PCR -teknologiaa käyttämällä ei tarvita tylsiä nukleiinihappojen puhdistusprosessia, näytetemplaatti voidaan valmistaa 10 minuutissa ja vastaava PCR-reaktiojärjestelmä voidaan lisätä.
Ilmoitus:
Katkaisumenetelmällä on parempi havaitsemisvaikutus, ja saatua tuotetta voidaan käyttää useisiin detektioreaktioihin.
5.1: Lehtien suora laajeneminen
Leikkaa käsikirjan kuvan koon mukaan halkaisijaltaan 2-3 mm oleva lehtikudos ja aseta se PCR-reaktiojärjestelmään.
Huomautus: Varmista, että lehtifragmentit ovat täysin upotettuina PCR-reaktioliuokseen, äläkä lisää liikaa lehtikudosta.
5.2: Lehden halkaisumenetelmä
Leikkaa lehtikudos, jonka halkaisija on 5-7 mm ja aseta se sentrifugiputkeen.Jos valitset kypsiä lehtiä, älä käytä lehden päälaskimokudoksia.Pipetoi 50 ul puskuri P1 -lysaattia sentrifugiputkeen varmistaaksesi, että lysaatti voi upottaa lehtikudoksen kokonaan, aseta se lämpökiertolaitteeseen tai metallihauteeseen ja lysoi 95 °C:ssa 5-10 minuuttia.
Lisää 50 ul Buffer P2 neutralointiliuosta ja sekoita hyvin.Saatua lysaattia voidaan käyttää templaattina ja lisätä PCR-reaktiojärjestelmään.
Huomautus: Templaatin määrä on välillä 5-10 % PCR-järjestelmästä, eikä se saa ylittää 20 % (esimerkiksi 20 μl PCR-järjestelmässä, lisää 1-2 μl lyysiliuosta, enintään 4 μl).
Vaihe 6
PCR-reaktio
PCR-reaktioputken sentrifugoinnin jälkeen se asetetaan PCR-instrumenttiin monistusta varten.
Ilmoitus:
Reaktiossa käytetään amplifiointiin puhdistamatonta templaattia, joten monistussyklien lukumäärä on 5-10 sykliä enemmän kuin puhdistettua DNA-templaattia käytettäessä.
Vaihe 7
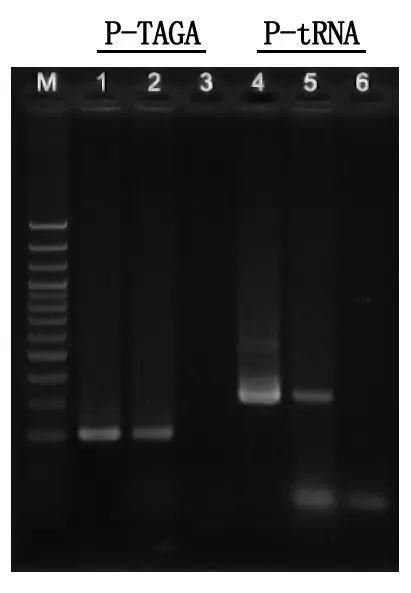
Elektroforeesin havaitseminen ja tulosanalyysi
M: 100 bp DNA Ladder
1\4: Puhdistettu DNA -menetelmä
2\5: Suora PCR-menetelmä
3\6: Tyhjä ohjausobjekti
QC:
Kokeessa asetettujen eri kontrollien testitulosten tulee täyttää seuraavat ehdot.Muussa tapauksessa ongelman syy on analysoitava ja testi on suoritettava uudelleen, kun ongelma on poistettu.
Taulukko 1. Eri kontrolliryhmien normaalit testitulokset
*Kun plasmidia käytetään positiivisena kontrollina, endogeenisen geenin testitulos voi olla negatiivinen
Lopputulos:
A. Näytteen endogeenisen geenin testitulos on negatiivinen, mikä viittaa siihen, että näytteestä ei voida erottaa tavalliseen PCR-detektioon sopivaa DNA:ta tai uutettu DNA sisältää PCR-reaktion estäjiä ja DNA on uutettava uudelleen.
B. Näytteen endogeenisen geenin testitulos on positiivinen ja eksogeenisen geenin testitulos negatiivinen, mikä viittaa siihen, että näytteestä erotetaan tavalliseen PCR-detektioon sopivaa DNA:ta ja voidaan päätellä, että XXX-geeniä ei löydy näytteestä.
C. Näytteen endogeenisen geenin testitulos on positiivinen ja eksogeenisen geenin testitulos positiivinen, mikä viittaa siihen, että näytteestä on erotettu tavalliseen PCR-detektioon sopivaa DNA:ta ja näyte-DNA sisältää XXX-geenin.Vahvistuskokeita voidaan suorittaa edelleen.
Vaihe 8
Suunnittele tunnistusalukkeet
Käytä kokeen jälkeen 2 % natriumhypokloriittiliuosta ja 70 % etanoliliuosta koealueen pyyhkimiseen ympäristön saastumisen estämiseksi.
Postitusaika: 08.09.2021