PCR (polymeraasiketjureaktio) on yksi in vitro DNA:n monistustekniikoista, jolla on yli 30 vuoden historia.
PCR-teknologian edelläkävijä Kary Mullis Cetuksesta, USA:sta vuonna 1983. Mullis haki PCR-patenttia vuonna 1985 ja julkaisi ensimmäisen PCR-akateemisen tutkimuksen samana vuonna.Mullis sai työstään Nobelin kemian palkinnon vuonna 1993.
PCR:n perusperiaatteet
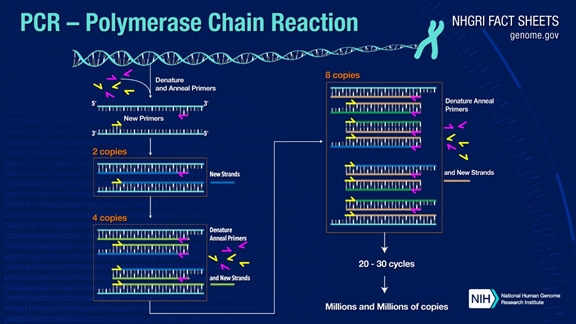
PCR voi monistaa kohde-DNA-fragmentteja yli miljoona kertaa.Periaatteena on DNA-polymeraasin katalyysi, jossa käytetään emäjuoste-DNA:ta templaattina ja spesifistä aluketta pidentämisen lähtökohtana.Se replikoituu in vitro sellaisilla vaiheilla kuin denaturaatio, pariutuminen ja pidentäminen.Tytärjuosteen DNA:n prosessi, joka on komplementaarinen emäjuosteen templaatti-DNA:lle.
Tavallinen PCR-prosessi on jaettu kolmeen vaiheeseen:
1. Denaturaatio: Käytä korkeaa lämpötilaa DNA:n kaksoisjuosteiden erottamiseen.Vetysidos DNA:n kaksoisjuosteiden välillä katkeaa korkeassa lämpötilassa (93-98 ℃).
2. Pariutuminen: Kun kaksijuosteinen DNA on erotettu, alenna lämpötilaa, jotta aluke voi sitoutua yksijuosteiseen DNA:han.
3. Extension: DNA-polymeraasi alkaa syntetisoida komplementaarisia juosteita pitkin DNA-säikeitä sitoutuneista alukkeista, kun lämpötilaa lasketaan.Kun pidennys on valmis, sykli päättyy ja DNA-fragmenttien määrä kaksinkertaistuu
Kun näitä kolmea vaihetta edestakaisin 25-35 kertaa, DNA-fragmenttien määrä kasvaa eksponentiaalisesti.
PCR:n kekseliäisyys on, että eri kohdegeeneille voidaan suunnitella erilaisia alukkeita, jolloin kohdegeenifragmentit voidaan monistaa lyhyessä ajassa.
Toistaiseksi PCR voidaan jakaa kolmeen kategoriaan, nimittäin tavalliseen PCR:ään, fluoresoivaan kvantitatiiviseen PCR:ään ja digitaaliseen PCR:ään.
Tavallisen PCR:n ensimmäinen sukupolvi
Käytä tavallista PCR-amplifikaatioinstrumenttia kohdegeenin monistamiseen ja käytä sitten agaroosigeelielektroforeesia tuotteen havaitsemiseen. Vain kvalitatiivinen analyysi voidaan tehdä.
Ensimmäisen sukupolven PCR:n tärkeimmät haitat:
1. Altis epäspesifiselle vahvistukselle ja väärille positiivisille tuloksille.
2. Havaitseminen kestää kauan ja toiminta on hankalaa.
3. Vain laadullinen testi voidaan tehdä
Toisen sukupolven reaaliaikainen PCR
Reaaliaikainen PCR, joka tunnetaan myös nimellä qPCR, käyttää fluoresoivia koettimia, jotka voivat osoittaa reaktiojärjestelmän etenemisen, ja tarkkailee vahvistettujen tuotteiden kertymistä fluoresoivien signaalien kerääntymisen kautta ja arvioi tuloksia fluoresenssikäyrän avulla.Se voidaan kvantifioida Cq-arvon ja standardikäyrän avulla.
Koska qPCR-tekniikkaa toteutetaan suljetussa järjestelmässä, kontaminaation todennäköisyys pienenee ja fluoresenssisignaalia voidaan tarkkailla kvantitatiivista havaitsemista varten, joten se on laajimmin käytetty kliinisessä käytännössä ja siitä on tullut hallitseva tekniikka PCR:ssä.
Reaaliaikaisessa fluoresoivassa kvantitatiivisessa PCR:ssä käytetyt fluoresoivat aineet voidaan jakaa: TaqMan fluoresoiva koetin, molekyylimajakat ja fluoresoiva väriaine.
1) TaqMan fluoresoiva anturi:
PCR-monistuksen aikana lisätään spesifinen fluoresoiva koetin samalla kun lisätään alukepari.Koetin on oligonukleotidi, ja molemmat päät on leimattu reportterifluoresoivalla ryhmällä ja sammuttajafluoresoivalla ryhmällä.
Kun koetin on ehjä, sammutusryhmä absorboi reportteriryhmän lähettämän fluoresoivan signaalin;PCR-monistuksen aikana Taq-entsyymin 5'-3'-eksonukleaasiaktiivisuus katkaisee ja hajottaa koettimen, jolloin reportterifluoresoiva ryhmä ja sammuttaja Fluoresoiva ryhmä erotetaan siten, että fluoresenssin seurantajärjestelmä voi vastaanottaa muodostuneen fluoresenssisignaalin, eli joka kerta kun DNA-juoste fluoresoi, fluoresoi ja fluoresoi DNA-juoste. on täysin synkronoitu PCR-tuotteen muodostumisen kanssa.
2) SYBR-fluoresoiva väriaine:
PCR-reaktiojärjestelmässä lisätään ylimäärä SYBR-fluoresoivaa väriainetta.Kun SYBR-fluoresoiva väriaine on epäspesifisesti liitetty DNA:n kaksoisjuosteeseen, se lähettää fluoresoivan signaalin.SYBR-väriainemolekyyli, jota ei ole sisällytetty ketjuun, ei lähetä fluoresoivaa signaalia, mikä varmistaa fluoresoivan signaalin. PCR-tuotteiden lisääntyminen on täysin synkronoitu PCR-tuotteiden lisääntymisen kanssa.SYBR sitoutuu vain kaksijuosteiseen DNA:han, joten sulamiskäyrää voidaan käyttää määrittämään, onko PCR-reaktio spesifinen.
3) Molekyylimajakka:
Se on varsisilmukka kaksoisleimattu oligonukleotidikoetin, joka muodostaa noin 8 emäksen hiusneularakenteen 5 ja 3 päässä.Molemmissa päissä olevat nukleiinihapposekvenssit ovat komplementaarisesti pariutuneet, mikä saa aikaan fluoresoivan ryhmän ja sammutusryhmän tiukan.Sulje, fluoresenssia ei synny.
Kun PCR-tuote on muodostunut, molekyylimajakan keskiosa yhdistetään pariutumisprosessin aikana spesifisen DNA-sekvenssin kanssa ja fluoresoiva geeni erotetaan sammuttajageenistä fluoresenssin tuottamiseksi.
Toisen sukupolven PCR:n tärkeimmät haitat:
Herkkyys on edelleen puutteellinen, ja vähäisten näytteiden tunnistus on epätarkka.
Tausta-arvo vaikuttaa, ja tulos on herkkä häiriöille.
Kun reaktiojärjestelmässä on PCR-estäjiä, havaitsemistulokset ovat herkkiä häiriöille.
Kolmannen sukupolven digitaalinen PCR
Digitaalinen PCR (DigitalPCR, dPCR, Dig-PCR) laskee kohdesekvenssin kopiomäärän päätepisteen havaitsemisen avulla ja voi suorittaa tarkan absoluuttisen kvantitatiivisen havaitsemisen ilman sisäisiä kontrolleja ja standardikäyriä.
Digitaalinen PCR käyttää päätepisteiden havaitsemista, eikä se riipu Ct-arvosta (syklin kynnysarvo), joten amplifikaatiotehokkuus vaikuttaa vähemmän digitaaliseen PCR-reaktioon ja PCR-reaktion estäjien sietokyky paranee suurella tarkkuudella ja toistettavuudella.
Korkean herkkyyden ja suuren tarkkuuden ominaisuuksien vuoksi PCR-reaktion estäjät eivät helposti häiritse sitä, ja se voi saavuttaa todellisen absoluuttisen kvantifioinnin ilman standardituotteita, joista on tullut tutkimuksen ja sovellusten hotspot.
Reaktioyksikön eri muotojen mukaan se voidaan jakaa kolmeen päätyyppiin: mikrofluidi-, siru- ja pisarajärjestelmät.
1) Mikrofluidinen digitaalinen PCR, mdPCR:
Mikrofluiditekniikan perusteella DNA-templaatti erotetaan.Mikrofluiditeknologialla voidaan toteuttaa näytteen nano-päivitys tai pienempien pisaroiden generointi, mutta pisarat tarvitsevat erityisen adsorptiomenetelmän ja yhdistetään sitten PCR-reaktiojärjestelmään.mdPCR on vähitellen otettu käyttöön muilla menetelmillä korvata.
2) Pisarapohjainen digitaalinen PCR, ddPCR:
Käytä vesi öljyssä -pisaroiden generointiteknologiaa näytteen prosessoimiseen pisaroiksi ja jaa nukleiinihappomolekyylejä sisältävä reaktiojärjestelmä tuhansiksi nanomittakaavan pisaroiksi, joista jokainen ei sisällä havaittavaa nukleiinihappokohdemolekyyliä tai sisältää yhdestä useampaan testattavaa nukleiinihappokohdemolekyyliä.
3) Sirupohjainen digitaalinen PCR, cdPCR:
Käytä integroitua nestereittitekniikkaa monien mikroputkien ja mikroonteloiden kaivertamiseen piikiekkoihin tai kvartsilasiin ja liuoksen virtauksen ohjaamiseen eri säätöventtiilien kautta ja jakaa näyteneste samankokoisiin nanometreihin reaktiokuopiksi digitaalista PCR-reaktiota varten absoluuttisen kvantifioinnin saavuttamiseksi.
Kolmannen sukupolven PCR:n tärkeimmät haitat:
Laitteet ja reagenssit ovat kalliita.
Mallin laatuvaatimukset ovat korkeat.Jos mallin määrä ylittää mikrojärjestelmän määrän, kvantifiointi on mahdotonta, ja jos se on liian pieni, kvantifioinnin tarkkuus heikkenee.
Vääriä positiivisia voi myös luoda, kun on olemassa epäspesifinen vahvistus.
Postitusaika: 30.7.2021