Ct-arvo on fluoresoivan kvantitatiivisen PCR:n tärkein tulosten esitysmuoto.Sitä käytetään geenien ilmentymiserojen tai geenikopioluvun laskemiseen.Joten mikä on fluoresenssin kvantifioinnin Ct-arvo, jota pidetään kohtuullisena?Kuinka varmistaa Ct-arvon tehokas alue?
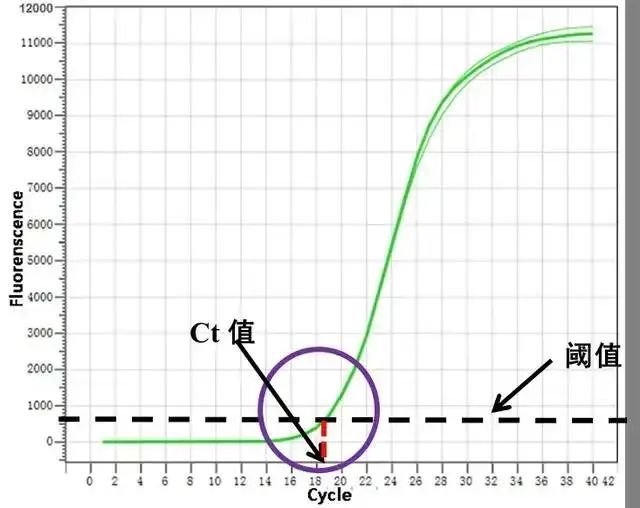
Mikä on Ct-arvo?
qPCR-vahvistusprosessin aikana vastaava määrä vahvistusjaksoja (Cycle Threshold), kun vahvistetun tuotteen fluoresenssisignaali saavuttaa asetetun fluoresenssikynnyksen.C on lyhenne sanoista Cycle ja T tarkoittaa kynnystä.Yksinkertaisesti sanottuna Ct-arvo on syklien lukumäärä, joka vastaa sitä, kun alkuperäinen templaatin monistus saavuttaa tietyn määrän tuotetta qPCR:ssä.Niin sanottu "tiety määrä tuotetta" selitetään tarkemmin myöhemmin.
Mitä Ct-arvo tekee?
1. Eksponentiaalisen vahvistuksen, mallin määrän ja Ct-arvon välinen suhde
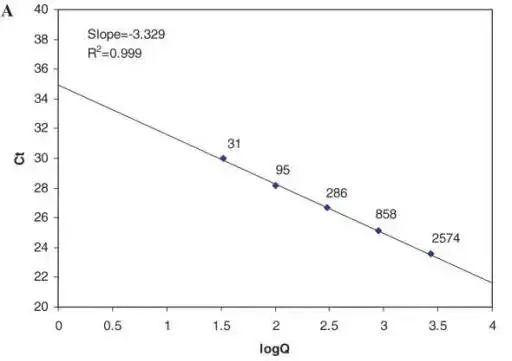
Ihannetapauksessa qPCR:n geenit kerääntyvät eksponentiaalisella amplifikaatiolla tietyn syklien määrän jälkeen.Vahvistusjaksojen lukumäärän ja tuotteiden määrän välinen suhde on: Monistetun tuotteen määrä = alkuperäisen mallin määrä × (1+En) syklien lukumäärä.qPCR-reaktio ei kuitenkaan aina ole ihanteellisessa tilanteessa.Kun vahvistetun tuotteen määrä saavuttaa "tietyn tuotemäärän", syklien lukumäärä tällä hetkellä on Ct-arvo, ja se on eksponentiaalisessa vahvistusjaksossa.Ct-arvon ja aloitusmallin määrän välinen suhde: Mallin Ct-arvon ja mallin aloituskopionumeron logaritmin välillä on lineaarinen suhde.Mitä korkeampi templaatin alkupitoisuus, sitä pienempi Ct-arvo;mitä pienempi templaatin alkupitoisuus, sitä suurempi Ct-arvo.
2. Amplifikaatiokäyrä, fluoresenssikynnys ja tietty PCR-tuotteen määrä
qPCR-monistustuotteen määrä esitetään suoraan fluoresoivan signaalin, toisin sanoen vahvistuskäyrän, muodossa.PCR:n alkuvaiheessa amplifikaatio on ihanteellisissa olosuhteissa, syklien määrä on pieni, tuotteen kertymä on pieni, eikä fluoresenssin tasoa voida selvästi erottaa fluoresenssin taustasta.Sen jälkeen fluoresenssi kasvaa ja siirtyy eksponentiaaliseen vaiheeseen.PCR-tuotteen määrä voidaan havaita tietyssä vaiheessa, kun PCR-reaktio on juuri eksponentiaalisessa vaiheessa, jota voidaan käyttää "tietynä tuotteena", ja tästä voidaan päätellä templaatin alkuperäinen sisältö.Siksi tiettyä tuotemäärää vastaava fluoresenssisignaalin intensiteetti on fluoresenssikynnys.
PCR:n myöhäisessä vaiheessa amplifikaatiokäyrä ei enää näytä eksponentiaalista monistumista ja siirtyy lineaariseen vaiheeseen ja tasannevaiheeseen.
3. Ct-arvojen toistettavuus
Kun PCR-sykli saavuttaa Ct-arvon syklinumeron, se on juuri siirtynyt todelliseen eksponentiaaliseen vahvistusjaksoon.Tällä hetkellä pientä virhettä ei ole vahvistettu, joten Ct-arvon toistettavuus on erinomainen, eli samaa mallia vahvistetaan eri aikoina tai eri putkissa samaan aikaan.Vahvistus, saatu Ct-arvo on vakio.
1. Vahvistustehokkuus En
PCR-monistuksen tehokkuus viittaa tehokkuuteen, jolla polymeraasi muuntaa monistettavan geenin amplikoniksi.Monistuksen tehokkuus, kun yksi DNA-molekyyli transformoidaan kahdeksi DNA-molekyyliksi, on 100 %.Vahvistustehokkuus ilmaistaan yleensä En.Seuraavien artikkelien analysoinnin helpottamiseksi esitellään lyhyesti vahvistustehokkuuteen vaikuttavat tekijät.
| Vaikuttavat tekijät | selitys | Kuinka tuomita? |
| A. PCR-estäjät | 1. Templaatti-DNA sisältää aineita, jotka estävät PCR-reaktion, kuten proteiineja tai pesuaineita.2. Käänteistranskription jälkeinen cDNA sisältää suuren pitoisuuden templaatti-RNA- tai RT-reagenssikomponentteja, jotka voivat myös estää myöhemmän PCR-reaktion. | 1. Saastuminen voidaan arvioida mittaamalla A260/A280- ja A260/A230-suhde tai RNA-elektroforeesi.2. Onko cDNA laimennettu tietyn suhteen mukaan käänteistranskription jälkeen. |
| B. Virheellinen pohjamaalisuunnittelu | Pohjusteet eivät hehkuudu tehokkaasti | Tarkista pohjustusdimeerien tai hiusneulien, yhteensopimattomuuden ja joskus intronisten kuvioiden ulottuvuuden varalta. |
| C. Virheellinen PCR-reaktioohjelman suunnittelu | 1. Pohjusteet eivät voi hehkuttaa tehokkaasti2. Riittämätön DNA-polymeraasin vapautuminen 3. Pitkäaikainen korkean lämpötilan DNA-polymeraasiaktiivisuus väheni | 1. Hehkutuslämpötila on korkeampi kuin alukkeen TM-arvo2. Esidenaturointiaika on liian lyhyt 3. Reaktiomenettelyn kunkin vaiheen aika on liian pitkä |
| D. Riittämätön reagenssien sekoitus tai pipetointivirheet | Reaktiojärjestelmässä PCR-reaktiokomponenttien paikallinen pitoisuus on liian korkea tai epätasainen, mikä johtaa PCR-monistuksen ei-eksponentiaaliseen monistumiseen | |
| E. Amplikonin pituus | Amplikonin pituus on liian pitkä, yli 300 bp, ja vahvistusteho on alhainen | Tarkista, että amplikonin pituus on 80-300 bp |
| F. qPCR-reagenssien vaikutus | DNA-polymeraasin pitoisuus reagenssissa on alhainen tai puskurin ionien pitoisuutta ei ole optimoitu, jolloin Taq-entsyymiaktiivisuus ei saavuta maksimia | Vahvistustehokkuuden määritys standardikäyrällä |
2.Ct-arvojen alue
Ct-arvot vaihtelevat välillä 15-35.Jos Ct-arvo on alle 15, katsotaan, että vahvistus on perusjakson alueella eikä fluoresenssin kynnysarvoa ole saavutettu.Ihannetapauksessa Ct-arvon ja mallin alkuperäisen kopionumeron logaritmin, toisin sanoen standardikäyrän, välillä on lineaarinen suhde.Standardikäyrän läpi, kun monistusteho on 100 %, laskettu Ct-arvo geenin yksittäiskopioluvun kvantifiointiin on noin 35. Jos se on suurempi kuin 35, templaatin alkukopioluku on teoreettisesti pienempi kuin 1, jota voidaan pitää merkityksettömänä.
Eri geenin Ct-alueille, johtuen erosta geenin kopiomäärässä ja amplifikaatiotehokkuudessa alkuperäisessä templaattimäärässä, on tarpeen tehdä geenille standardikäyrä ja laskea geenin lineaarinen havaitsemisalue.
3.Ct-arvon vaikuttavat tekijät
Vahvistusjaksojen lukumäärän ja tuotteen määrän välisestä suhteesta: vahvistetun tuotteen määrä = alkuperäisen templaatin määrä × (1+En) syklin numero, voidaan nähdä, että ihanteellisissa olosuhteissa alkuperäisen templaatin ja En:n määrällä on negatiivinen vaikutus Ct-arvoon.Ero mallin laadussa tai vahvistustehokkuudessa aiheuttaa Ct-arvon olevan liian suuri tai liian pieni.
4.Ct-arvo on liian suuri tai liian pieni
Postitusaika: 22.2.2023