PCR, useita PCR, In situ PCR, Käänteinen PCR, RT-PCR, qPCR (1)–PCR
Selvitämme erilaisten PCR-menetelmien käsitteet, vaiheet ja yksityiskohdat
Ⅰ. PCR
Polymeraasiketjureaktio, josta käytetään nimitystä PCR, on molekyylibiologinen tekniikka, jota käytetään spesifisten DNA-fragmenttien suurentamiseen.Sitä voidaan pitää erityisenä DNA-replikaationa in vitro.DNA-polymeraasi (DNA-polymeraasi I) löydettiin jo vuonna 1955, ja Klenow-fragmentti E. Colista, jolla on kokeellista arvoa ja käytännöllisyyttä, löysi tohtori H. Klenow 1970-luvun alussa, mutta koska tämä entsyymi ei siedä lämpötilaa, korkea lämpötila voi degeneroida sen, joten se ei täytä polymeraasin korkean lämpötilan degeneraatioketjureaktiota.Nykyään käytössä olevat entsyymit (kutsutaan Taq-polymeraasiksi) eristettiin Thermus aquaticuksesta, kuuman lähteen bakteerista vuonna 1976. Sen ominaisuus on, että se kestää korkeita lämpötiloja ja on ihanteellinen entsyymi, mutta sitä on käytetty laajalti 1980-luvun jälkeen.Alkuperäisen PCR:n primitiivisen prototyypin alkuperäinen konsepti on samanlainen kuin geenin korjaus ja kopiointi, jota tohtori KJell Kleppe ehdotti vuonna 1971. Hän julkaisi ensimmäisen yksinkertaisen ja lyhytaikaisen geenikopion (samanlainen kuin PCR:n kaksi ensimmäistä syklireaktiota).Nykyään kehitetyn PCR:n kehitti tohtori Kary B. Mullis vuonna 1983. Tri Mullis palveli PE-yrityksiä sinä vuonna, joten PE:llä on erityinen asema PCR-teollisuudessa.Tohtori Mullis julkaisi virallisesti ensimmäisen aiheeseen liittyvän artikkelin Saikin ja muiden kanssa vuonna 1985. Siitä lähtien PCR:n käyttö on ollut tuhansia kilometrejä päivässä, ja asiaan liittyvien papereiden laadun voidaan sanoa tekevän monista muista tutkimusmenetelmistä epämiellyttäviä.Myöhemmin PCR-tekniikkaa käytetään laajasti biologisessa tieteellisessä tutkimuksessa ja kliinisissä sovelluksissa, ja siitä on tulossa molekyylibiologian tutkimuksen tärkein teknologia.Mullis voitti myös vuoden 1993 kemian Nobelin.
PCRPeriaate
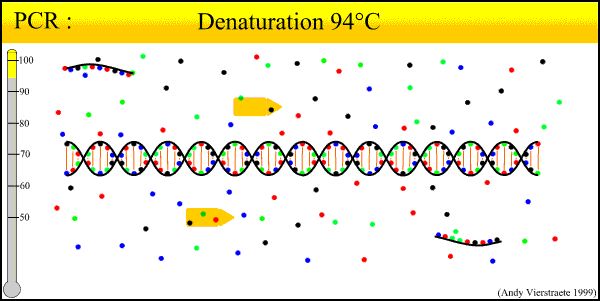
PCR-tekniikan perusperiaate on samanlainen kuin DNA:n luonnollinen replikaatioprosessi, ja sen spesifisyys riippuu oligonukleotidialukkeesta, joka on komplementaarinen kohdesekvenssin molemmille päille.PCR koostuu kolmesta degeneraatio-pariutumis-pidennysvaiheesta: ①Templaatti-DNA:n degeneraatio: Kun templaatti-DNA:ta on kuumennettu noin 93°C:een tietyn ajan, kaksois-DNA-liuos templaatti-DNA:n poistumisen PCR-monistuksella muodostuu kaksois-DNA-liuos, joka valmistetaan yhdistetyksi alukereaktion kanssa seuraavaan kierrokseen.② Templaatti-DNA:n ja alukkeen pariutuminen (yhdiste): Kun templaatti-DNA on kuumennettu ja degeneroitunut yhdeksi ketjuksi, lämpötila laskee noin 55 °C:seen.Alukkeen ja templaatti-DNA:n yksiketjuinen komplementaarinen sekvenssi.③Alukkeen pidennys: DNA-templaatti - alukkeen sitoutuminen perustuu TaqDNA-polymeraasin toimintaan dNTP:n ollessa reaktion raaka-aineena.Säilytä replikaation periaate, syntetisoi uusi puolivarattu kopioketju, joka täydentää templaatti-DNA-ketjua, ja toista syklin rappeutuminen-pariutuminen-pidennys kolmella prosessilla voi saada lisää "puolivarattua kopioketjua", ja tämä uusi ketju on jälleen saatavilla. Ryhdy malliksi seuraavalle syklille.Silmukan valmistuminen kestää 2-4 minuuttia, kohdegeeni voi monistua useita miljoonia kertoja 2-3 tunnissa.
VakioPCRReaktiojärjestelmä
| Taq DNA -polymeraasi | 2,5 μl |
| Mg2+ | 1,5 mmol/l |
| 10x vahvistuspuskuri | 10 μl |
| 4 dNTP-seosta | 200 μl |
| Malli-DNA | 0,1-2 μg |
| Primer | 10-100 μl |
| Lisää kaksin- tai kolminkertainen höyrytysvesi | 100 μl |
Viisi PCR-reaktion elementtiä
PCR-reaktiossa on mukana pääasiassa viisi erilaista ainetta, nimittäin aluke, entsyymi, dNTP, templaatti ja puskuri (tarvitaan Mg2+).[PCR-menettely]
Tavallinen PCR-prosessi on jaettu kolmeen vaiheeseen
1. DNA:n degeneraatio (90°C-96°C): Kaksiketjuiset DNA-templaatit lämpövaikutuksen alaisena, vetysidokset katkeavat muodostaen yksiketjuisen DNA:n.
2. Hehkutus (25℃ -65℃): Järjestelmän lämpötilaa lasketaan, aluke yhdistetään DNA-templaattiin paikallisen kaksoisketjun muodostamiseksi.
3. Pidentäminen (70℃ -75℃): Taq-entsyymin vaikutuksesta (noin 72°C, paras aktiivisuus) dNTP:tä käytetään raaka-aineena, ulottuu alukkeen 5′-päästä → 3′-pää, synteesi ja templaatti täydentävät toisiaan DNA-ketjuja.
Jokainen sykli denaturoidaan, paritetaan ja pidennetään, mikä kaksinkertaistaa DNA-sisällön.Tällä hetkellä lyhyen amplifikaatioalueen vuoksi osa PCR:stä voidaan replikoida hyvin lyhyessä ajassa, vaikka Taq-entsyymiaktiivisuus ei olisi optimaalinen, joten se voidaan muuttaa kahdeksi vaiheeksi, eli pariutuminen ja pidennys voidaan suorittaa 60 °C-65 °C:ssa samanaikaisesti.Nosto- ja jäähdytysprosessin vähentämiseksi ja vastenopeuden parantamiseksi.
PCR-reaktion ominaisuudet
● Erittäin tarkka
PCR-vasteen spesifiset ratkaisevat tekijät ovat: ①Alukkeen ja templaatti-DNA:n spesifinen yhdistelmä.② Peruspariliitoksen periaate.③TaqDNA-polymeraasin synteesireaktion uskollisuus.④Kohdegeenin spesifisyys ja konservatiivisuus.
Oikea pohjamaalien ja mallien yhdistelmä on avainasemassa.Alukkeen ja templaatin sitoutuminen ja alukeketjun pidentäminen perustuvat alkalisen emässovituksen periaatteeseen.Polymeraasisynteesireaktioiden uskollisuus ja Taq DNA -polymeraasin korkean lämpötilan kestävyys templaatin ja alukkeen sitoutumisen (yhdisteen) aikaansaamiseksi reaktiossa voidaan suorittaa korkeammassa lämpötilassa.Yhdistelmän spesifisyys lisääntyy huomattavasti.Klipsi voi säilyttää korkean oikeellisuusasteen.Valitsemalla geneettisen kohdealueen, jolla on korkea konservatiivisuus ja korkea konservatiivisuus, sen spesifisyys on korkeampi.
● Korkea herkkyys
PCR-tuotteiden tuotantomäärää nostetaan indeksillä, mikä voi laajentaa Pickerin aloitusmallia (PG=10-12) nostaakseen mikrokontrollerin tason mikrogrammien tasolle (μg= -6).Kohdesolu voidaan havaita 1 miljoonasta solusta;virusten havaitsemisessa PCR:n herkkyys voi olla 3 RFU:ta (tyhjiä täpliä muodostettuja yksiköitä);bakteeritieteen pienin havaitsemisprosentti on 3 bakteeria.
● Yksinkertainen ja nopea
PCR-heijastuksessa käytetään korkean lämpötilan Taq DNA -polymeraasia, joka lisää reaktioliuoksen kerralla, eli degeneraatio-pariutumis-pidennysreaktion DNA-monistusliuokseen ja vesihaudeastiaan.Yleisesti monistusreaktio on valmis 2 - 4 tunnissa.Laajennetut tuotteet analysoidaan yleensä sähkömiekalla, eikä niiden tarvitse käyttää isotooppeja, ei radioaktiivista saastumista ja helppoa mainostamista.
● Näytteen puhtaus on alhainen
Ei ole tarvetta erottaa viruksia tai bakteereja ja viljellä soluja.DNA:n raakatuotteita ja RNA:ta voidaan käyttää vahvistimina.DNA-monistuksen havaitsemista voidaan käyttää suoraan käyttämällä kliinisiä näytteitä, kuten verta, kehon nestettä, yskänpesunestettä, hiuksia, soluja ja elävää kudosta.
PCRyleisiä ongelmia
● Väärin negatiivinen, ei vahvistettuja kaistaa
PCR-reaktion keskeisiä vaiheita ovat: ① templaattinukleiinihappojen valmistus, ② alukkeiden laatu ja spesifisyys, ③ entsyymien laatu ④ PCR-syklin olosuhteet.Syyn löytämistä tulee myös analysoida ja tutkia yllä olevien linkkien osalta.
Templaatit: ① Templaatti sisältää sekalaista proteiinia, ② Templaatti sisältää Taq-entsyymi-inhibiittoria, ③ Templaatin proteiini ei poistu, etenkään kromosomissa oleva ryhmäproteiini.⑤ Deminer-nukleiinihappojen rappeutuminen ei ole perusteellista.Kun entsyymien ja alukkeiden laatu on hyvä, ei ole amplifikaatiovyöhykettä, mikä on todennäköisesti näytteiden ruoansulatushoitoa.Templaattinukleiinihapon uuttoprosessissa on jotain vialla, joten tehokkaan ja vakaan digestioliuoksen valmistamiseksi sen menettely tulee olla kiinteä eikä sitä saa muuttaa mielivaltaisesti.
Entsyymin inaktivointi: uutta entsyymiä tai sekä vanhoja että uusia entsyymejä tulee käyttää yhdessä analysoimaan, onko entsyymiaktiivisuus hävinnyt tai riittämätön, mikä johtaa vääriin negatiivisiin tuloksiin.On huomattava, että Taq-entsyymi tai etidiumbromidi joskus unohdetaan.
Pohja: alukkeen laatu, alukkeen pitoisuus ja onko kahden alukkeen pitoisuus symmetrinen.Se on yleinen syy PCR-epäonnistumiseen tai kasvava vyöhyke ei ole ihanteellinen ja altis diffuusille.Joidenkin eränumeroiden alukkeiden laadussa on ongelmia.Näillä kahdella alukkeella on korkea pitoisuus ja alhainen pitoisuus, mikä aiheuttaa alhaisen tehokkuuden epäsymmetristä monistusta.Vastatoimenpiteet ovat: ① Valitse hyvä aluke yksiköiden syntetisoimiseksi.② Alukkeen konsentraatio ei riipu vain OD-arvosta, vaan se kiinnittää myös huomiota alukkeen alkuperäiseen nesteeseen agar-sokerigeelielektroforeesia varten.Pohjustusnauhavyöhykkeen on oltava, ja näiden kahden pohjusteen kirkkauden tulee olla yleisesti ottaen tasainen.Hihna, PCR saattaa epäonnistua tällä hetkellä, ja se tulisi ratkaista alukkeen synteesiyksiköllä.Jos pohjamaali on korkea, kirkkaus on alhainen ja sen pitoisuuden on oltava tasapainossa laimennettuna.③ Pohjustusaine on maksettava ja säilytettävä suuressa pitoisuudessa, jotta estetään jääkaapin useiden jäätymien tai pitkäaikaisen jäähtymisen aiheuttama primerin huononeminen ja hajoaminen.④ Pohjusteen suunnittelu on kohtuuton, kuten pohjamaalin pituus on riittämätön ja alukkeiden väliin muodostuu diklusteri.
Mg2+-pitoisuus: Mg2+ionikonsentraatiolla on suuri vaikutus PCR-monistuksen tehokkuuteen.Liiallinen pitoisuus voi vähentää PCR-monistuksen vastakkaista sukupuolta.Jos konsentraatio on liian alhainen, PCR-amplifikaatiotulos jopa tekee PCR-monistuksen epäonnistumisen ilman laajennuskaistaa.
Reaktiotilavuuden muutos: PCR-monistuksessa käytetty tilavuus on 20ul, 30ul ja 50ul tai 100ul, PCR-monistuksen sovelluksen suuri määrä asetetaan tieteellisen tutkimuksen ja kliinisen testauksen eri tarkoitusten mukaan.Kun on tehty pieniä määriä, kuten 20ul, on tarpeen tehdä johtokunto koon valmistuksessa, muuten se epäonnistuu.
Fyysiset syyt: Transformaatio on erittäin tärkeä PCR-monistuksen kannalta.Jos rappeutumislämpötila on alhainen, degeneraatioaika on lyhyt, se tapahtuu todennäköisesti väärissä negatiivisissa arvoissa;liian alhainen hehkutuslämpötila voi aiheuttaa epäspesifistä vahvistusta ja heikentää ominaisvahvistuksen tehokkuutta.Vaikuttaa voimakkaasti alukkeiden ja templaattien yhdistelmään PCR-monistuksen tehokkuuden vähentämiseksi.Joskus on tarpeen käyttää tavallisia lämpömittareita mittaamaan vaihtelua, hehkutusta ja pidentynyttä lämpötilaa jatko- tai vesiliukoisessa keittimessä, mikä on yksi syy PCR:n epäonnistumiseen.
Kohdesekvenssivariantit: Jos kohdesekvenssi tapahtuu, mutaatio tai deleetio, prototyypin ja templaatin yhdistelmä yhdistetään tai kohdesekvenssin puuttumisen vuoksi aluke ja templaatti menettävät komplementaarisen sekvenssin, eikä sen PCR-monistus onnistu.
● Väärä positiivinen
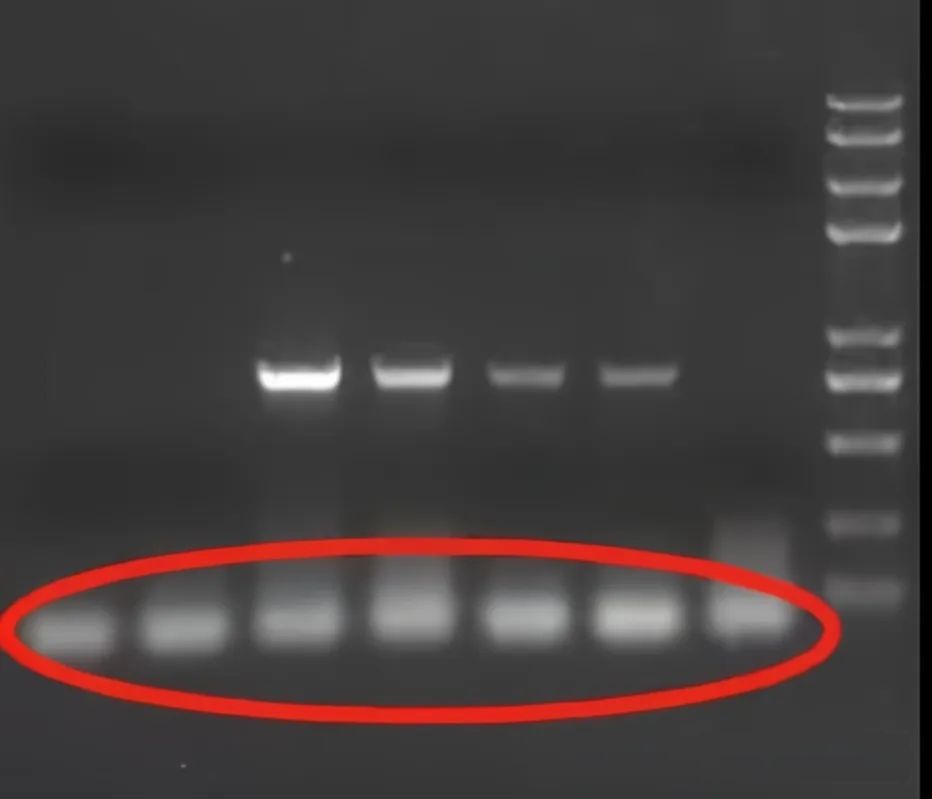
PCR-amplifikaatiovyöhyke näyttää olevan yhdenmukainen kohdesekvenssivyöhykkeen kanssa, ja joskus sen vyöhyke on siistimpi ja korkeampi.
Alukesuunnittelu ei ole sopiva: valitulla monistussekvenssillä ja ei-tarkoituksellisella monistussekvenssillä on homologisia, joten PCR-monistuksessa monistetut PCR-tuotteet ovat ei-tarkoituksellisia sekvenssejä.Kohdesekvenssi on liian lyhyt tai aluke on liian lyhyt, ja se on altis väärille positiivisille.On suunniteltava uudelleen.
Kohdesekvenssien tai amplifikaatiotuotteiden ristisaasteet: Tähän saastumiseen on kaksi syytä: Ensinnäkin koko genomin tai suurten segmenttien ristisaaste, joka johtaa vääriin positiivisiin tuloksiin.Tällainen väärä positiivinen tulos voidaan ratkaista seuraavilla menetelmillä: Ole varovainen ja varovainen käytön aikana, jotta kohdesekvenssi ei hengitä näytepistooliin tai roisku pois keskipakoputkesta.Lukuun ottamatta entsyymejä ja aineita, jotka eivät kestä korkeita lämpötiloja, kaikki reagenssit tai laitteet on desinfioitava korkealla paineella.Keskipakoputket ja -näytteet tulee käyttää kerralla.Tarvittaessa reaktioputki ja reagenssi altistetaan ennen näytteiden lisäämistä ultraviolettisäteille olemassa olevan nukleiinihapon tuhoamiseksi.Toiseksi pienet palaset ilmansaasteet.Nämä pienet fragmentit ovat lyhyempiä kuin kohdesekvenssi, mutta niillä on tietty homologia.Se voidaan yhdistää toisiinsa.Alukkeiden täydentämisen jälkeen PCR-tuotetta voidaan laajentaa, mikä aiheuttaa väärän positiivisen tuotannon.Sitä voidaan käyttää vähentämään tai poistamaan pesä-PCR-menetelmää.
● Näkyviin tulee epäspesifinen vahvistuskaista
PCR-monistuksen jälkeen ilmaantuneet juovat ovat epäjohdonmukaisia odotetun koon kanssa tai ovat suuria tai pieniä, tai samaan aikaan tai samaan aikaan spesifisiä monistusvyöhykkeitä ja epäspesifisiä amplifikaatiovyöhykkeitä.Epäspesifisten juovien ilmaantuminen on: Ensinnäkin alukkeet ovat epätäydellisiä komplementaarisia kohdesekvenssin kanssa tai alukkeen polymeroituminen muodostaen diklusterin.Toinen on se, että MG2+-ionien pitoisuus on liian korkea, pariutumislämpötila on liian alhainen ja PCR-syklien lukumäärä on suhteessa toisiinsa.Toiseksi entsyymien laatu ja määrä.Usein joidenkin lähteiden entsyymit ovat alttiita ei-erityisille vyöhykkeille ja toisen lähteen entsyymejä ei esiinny.Joskus tapahtuu myös entsyymien epäspesifistä monistumista.Vastatoimet ovat: uudelleen suunnitellut houkuttelevat tarvittaessa.Vähennä entsyymin määrää tai vaihda entsyymi toisesta lähteestä.Vähennä ensisijaisen määrän määrää, lisää mallien määrää asianmukaisesti ja vähennä jaksojen määrää.Nosta hehkutuslämpötilaa oikein tai käytä kahden lämpötilapisteen menetelmää (93 °C:n degeneraatio, hehkutus ja pidennys noin 65 °C:ssa).
● Näyttää hilseilevän rouvin tai tahrateipin
Joskus näyttää siltä, että PCR-amplifikaatiota käytetään tai kuorittu tai mattomainen vyö.Tästä syystä entsyymien liiallisesta määrästä tai entsyymin huonosta laadusta johtuen dNTP-pitoisuus on liian korkea, Mg2+-pitoisuus liian korkea, hehkutuslämpötila on liian alhainen ja syklien määrä on liian suuri.Vastatoimenpiteet ovat: ①Vähennä entsyymien määrää tai vaihda toisen lähteen entsyymi.②Pienennä dNTP:n pitoisuutta ③Pienennä Mg2+-pitoisuutta oikein.④Lisää mallien määrää ja vähennä jaksojen määrää.
Liittyvät tuotteet
PCR Heroᵀᴹ (väriaineen kanssa)
◮ Korkeampi tarkkuus: 6 kertaa tavallista Taq-entsyymiä parempi;
◮ Nopeampi vahvistusnopeus
◮ Lisää mallien mukauttavuutta
◮ Korkeampi vahvistusteho
◮ Ympäristön sietokyky on vahvempi: sijoitetaan 37 °C:seen viikoksi, yli 90 % aktiivisuus säilytetään;
◮ Sillä on 5'→3' DNA-polymeraasiaktiivisuutta ja 5'→3'-eksonukleaasiaktiivisuutta, ilman 3'→5'-eksonukleaasiaktiivisuutta.
PCR Easyᵀᴹ (väriaineen kanssa)
Ainutlaatuinen reaktiojärjestelmä ja erittäin tehokas Taq DNA Polymerase tekevät PCR-reaktiosta korkeamman monistustehokkuuden, spesifisyyden ja herkkyyden.
RT-qPCR Easyᵀᴹ (One Step)-SYBR Green I
◮ Yksivaiheinen pakkaus tekee käänteistranskriptiosta ja qPCR:stä kaksi reaktiota samassa putkessa, tarvitsee vain lisätä templaatti-RNA, spesifiset PCR-alukkeet ja RNaasi-Free ddH2O.
◮ Kitillä voidaan nopeasti ja tehokkaasti analysoida kvantitatiivisesti virus-RNA:ta tai jäljittää RNA:ta.
◮ Pakkauksessa käytetään ainutlaatuista Foregene-käänteistranskriptioreagenssia ja Foregene HotStar Taq DNA Polymerase yhdistettynä ainutlaatuiseen reaktiojärjestelmään, joka parantaa tehokkaasti monistustehokkuutta ja reaktion spesifisyyttä.
◮ Optimoidun reaktiojärjestelmän ansiosta reaktiolla on korkeampi havaitsemisherkkyys, vahvempi lämpöstabiilisuus ja parempi sietokyky.
◮ RT-qPCR EasyTM(One Step)-SYBR Green I -sarjan mukana tulee sisäinen ROX-referenssiväriaine, jolla voidaan eliminoida signaalin tausta ja signaalivirheet kuoppien välillä, mikä on asiakkaiden kätevää käyttää kvantitatiivisten PCR-instrumenttien eri malleissa.
RT HelppoTMII (Master Premix for ensimmäisen juosteen cDNA-synteesiReaaliaikainen PCR)
- Tehokas kyky poistaa gDNA, joka voi poistaa gDNA:n mallineesta 2 minuutissa.
- Tehokas käänteistranskriptiojärjestelmä, kestää vain 15 minuuttia ensimmäisen juosteen cDNA:n synteesin loppuun saattamiseksi.
- Monimutkaiset mallit: malleja, joissa on korkea GC-sisältö ja monimutkainen toissijainen rakenne, voidaan myös kääntää tehokkaasti.
- Korkean herkkyyden käänteiskopiointijärjestelmä, pg-tason mallit voivat myös saada korkealaatuista cDNA:ta.
-Käänteistranskriptiojärjestelmällä on korkea lämpöstabiilius, optimaalinen reaktiolämpötila on 42 ℃, ja sillä on edelleen hyvä käänteistranskriptiokyky 50 ℃:ssa.
Postitusaika: 18.3.2023